أهلا وسهلا بك إلى ملتقى الفيزيائيين العرب.
أهلا وسهلا بك زائرنا الكريم، إذا كانت هذه زيارتك الأولى للمنتدى، فيرجى التكرم بزيارة صفحة التعليمـــات، بالضغط هنا.
كما يشرفنا أن تقوم بالتسجيل بالضغط هنا إذا رغبت بالمشاركة في المنتدى، أما إذا رغبت بقراءة المواضيع والإطلاع فتفضل بزيارة القسم الذي ترغب أدناه.
| ملتقى الفيزيائيين العرب > منتديات أقسام الفيزياء > منتدى الفيزياء الكونية. | ||
| هل لهذا الكون من إله؟!! | ||
| الملاحظات |
|
|
أدوات الموضوع | انواع عرض الموضوع |
|
#11
|
||||||
|
||||||
مصطلح إنتروبية entropy (يعرب أحيانا بكلمة اعتلاج ) مصطلح أساسي و مفصلي ضمن التحريك الحراري خاصة بالنسبة للقانون الثاني للترموديناميك ، الذي يتعامل مع العمليات الفيزيائية و يبحث في شروط كونها عملية تلقائية ام لا . ينص القانون الثاني على مبدأ أساسي يقول بأن تغير تلقائي في نظام فيزيائي لا بد و ان يترافق بازدياد في مقدار إنتروبية هذا النظام. تميل التغيرات التلقائية عموما لأن تعدل من الاختلافات في الحرارة ، الضغط ، الكثافة ، و أيضا الكمون الكيميائي ضمن أي نظام فيزيائي او كيميائي بحيث تقلل الفوارق لأقل مقدار ممكن ليصل النظام لحالة من التوازن . الإنتروبية ضمن هذا المفهوم هي مقدار تقدم عملية التعديل هذه . بالمقابل ، نجد القانون الأول في الترموديناميك يتعامل مع مصطلح الطاقة التي تكون عادة محفوظة ضمن نظام فيزيائي مغلق . في نفس الوقت تعرف الإنتروبية على أنها تغير نحو حالة أكثر فوضوية على المستوى الجزيئي فالتغيرات التلقائية تميل دوما لكسب مزيد من الحرية لحركة الجزيئات او الذرات . في السنوات الأخيرة ، بدأ التعبير و شرح الإنتروبية على أنها "تشتت" dispersal للطاقة. تعتبر الإنتروبية دالة حالة انتشارية extensive تصف و تقيم تأثيرات اللاعكوسية في النظمة الترموديناميكية . و يرمز عادة ل الإنتروبية أو الاعتلاج بS أحد المصطلحات الأساسية في التحريك الحراري تمثل قياسا لمقدار الطاقة في النظام الفيزيائي التي لا يمكن استخدامها لإنتاج عمل ، و هذا يؤول بكلام آخر من منظور الميكانيك الإحصائي إلى أنها مقياس لمدى العشوائية أو انعدام النظام في الجملة الفيزيائية ، و يمكن على هذا الأساس القول أن الإعتلاج أيضا هو مقياس لمدى قابلية قلب عملية ترموديناميكية ما. في الترموديناميك تشكل الإنتروبية متغيرا فيزيائيا مهما لوصف نظام ترموديناميكي. نظام الواحدات الدولي أقر أن وحدة الإنتروبية هي بالجول لكل كلفن (J·K?1) ، و هي نفس واحدة السعة الحرارية، حيث تعتبر الإنتروبية مرافقة conjugate لدرجة الحرارة . سنة 1865 استعمل العالم رودولف كلاوسيوس مصطلح الإنتروبية و قدم التعريف التالي لها: 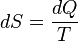 حيث T هي درجة الحرارة, Q مقدار الطاقة الحرارية و S مقدار الإعتلاج. و يمكن تحوير هذه المعادلة حتى تأخذ بعين الإعتبار قيمة العمل الضائع و ذلك عن طريق الإنطلاق من دالة لالجهد الترموديناميكي و بالتحديد من المعادلة للطاقة الداخلية: U = U(S,V) إذا قمنا بحساب التفاضل الكلي للطاقة الداخلية فإننا نتحصل على:  أي أن:  و إذا إستعنا بالصيغة التفاضلية للقانون الأول للتحريك الحراري: dU = dQ ? pdV + dWdissp حيث dWdissp = هو العمل الضائع و على هذا الأساس يمكن كتابة المعادلة التي تعرف الإنتروبية بهذه الطريقة:  و عن طريق هذه المعادلة نرى أن قيمة الإنتروبية تزداد أو تنقص إذا قمنا بتزويد نظام ما بالطاقة الحرارية أو سحبها منه. كما أنه مع تزايد قيمة العمل الضائع تتزايد الإنتروبية (العمل الضائع دائما موجب). كما أنه يمكن أن نقرأ من هذه المعادلة أنه بالنسبة لنظام أدياباتي (أي لا يمكنه تبادل طاقة حرارية أو مادة مع المحيط) أو نظام مغلق (لا يتبادل طاقة حرارية و لا عمل مع المحيط) فإن الإنتروبية لا يمكنها إلا أن تزداد. حيث أنه مثلا لا يمكن لكوب معزول حراريا تحصل فيه عملية إختلاط غير قابلة للعكس بين سائلين إلا أن تزداد فيه الإنتروبية. و تعتبر الإنتروبية متغير حر في الجهود الترمودينامية مثل الضغط و درجة الحرارة التي تصف الخواص المجهرية المقيسة للنظام . يوجد ارتباط مهم بين الإنتروبية و مقدار الطاقة الداخلية في النظام التي لا يمكن تحويلها لعمل . ففي أي عملية عندما يعطي النظام طاقة بمقدار ?E ، و تنخفض إنتروبيته بمقدار ?S فإن مقدارا TR ?S من هذه الطاقة على الأقل يجب أن يذهب لمحيط النظام بشكل حرارة غير قابلة للاستعمال ، و إلا فإن العملية لن تستمر . (TR هي حرارة المحيط الخارجي للنظام، الذي لا يمكن ان يكون بنفس درجة حرارة النظام T ). سنة 1865 اقترح لودفيغ بولتزمانوفق الميكانيك الإحصائي تعرقفا ىخر للإنتروبية. حسب بولتزمان تعتبر الإنتروبية مقياس لإحتمال حالة فزيائية معينة. و قد صاغ ذلك في القانون التالي: S = k.lnW حيث k هي ثابت بولتزمان و تساوي 1,380662.10 ? 23J / K و W هي احتمال حدوث حالة ترموديناميكية. و لفهم هذه المعادلة يمكننا تخيل نظام يتكون من جزيئين A و B و أن النظام يحتوي على 3 كوانتات من الطاقة فإن الحالة الترموديناميكية تتكون من موقع الجزيء في النظام و لنقل مثلا أنه هناك موقعين ممكنين مثلا كأن يكون الجزيء A في الموقع م1 و B في الموقع م2 أو العكس أي أن هناك إحتمالين لموقع الجزيئات ثم هناك أربع إحتمالات لتوزيع كوانتات الطاقة على الجزيئات ( مما يعطينا في المجموع ثمانية حالات ترموديناميكية للنظام و إذا إعتبرنا أن جميع الحالات لها نفس إحتمال الحدوث فإن قيمة الإنتروبية تعادل: 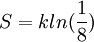 عامة يمكن إعتبار المعادلة التالية للإنتروبية:  حيث ?i هو الكمون الكميائي, p الضغط, T الحرارة, n عدد مولات مادة معينة في النظام. و انطلاقا من هذه المعادلة يمكن أن نرى أن الإنتروبية مهمة جدا لتعريف مصطلح التوازن الترمودينامي. حيث أنه في حالة التوازن الترمودينامي و التي هي الحالة التي يتوق و يحاول أي نظام أن يصل إليها نجد أن القوى الترمودينامية قد إختفت (المعاملات بين القوسين في المعادلة أعلاه) أي أن النظام له نفس الضغط كمحيطه و نفس درجة الحرارة و نفس الكمون الكميائي أو التركيز. ولعل من المعادلات المهمة في سياق ذكر الأنتروبية ما يعرف بعلاقات ماكسويل:  و التي يمكن أن نستنتج منها عدة علاقات مثل:  و لا يزال علماء الفيزياء يقرون بصحة القانون الثاني للترموديناميك
و انتقال الطاقة و الجسيمات لا يعني استحداث الطاقة من عدم أو افناء الطاقة و لا يزال العلماء يقرون بالقانون الأول للترموديناميك (قانون حفظ الطاقة) نظرية الكم وضعها العلما لتفسير بعض الظواهر الفيزيائية التي لا يمكن تفسيرها بالنظريات الكلاسيكية فلذلك لا تصلح أن تكون نظرية عامة إقرأ هذا المقال http://www.makphys.com/vb3/showthread.php?t=807 حدود تطبيق النظريتين الكلاسيكية و الكمية سوف أناقش في هذا التلخيص البسيط الذي قمت بكتابته مؤخرا متى يمكننا إستخدام النظريات الكلاسيكية و متى يمكننا إستخدام النظريات الكمية . او متى يمكننا إستخدام النظريات في "الحدود النسبية" و "الحدود اللانسبية" و اول سؤال يخطر في بالنا هل هناك ثابت يمكننا على أساسه إستخدام النظريات المناسبة ؟ انه ثابت بلانك و يرمز له تقريبا بالرمز (h) و قيمته تساوي h = 6.626 * 10^-27 erg sec or h = 60626*10-34 joule sec و على هذا فإن الأبعاد الفيزيائية لهذا الثابت هي زمن * طاقه = طول * كمية تحرك خطي = كمية تحرك زاوي و يطلق على هذه الكمية الفيزيائية مصطلح الفعل (action) و بالتبيعة فإن ثابت بلانك يسمى كم الفعل الأساسي . إذا بعد ان تعرفنا قليلا على ثابت بلانك سوف نستعرض متى يمكنا إستخدام كلا من النظريتين الكلاسيكيه و الكمية بالنظر لمتغير الغعل الذي يمثل أي حالة فيزيائية زمن * طاقه = طول * كمية تحرك خطي = كمية تحرك زاوي إذا كان نظام فيزيائي متغير ديناميكي أي اننا يمكننا تمييز حالة النظام مثل إحداثيات الموقع , مركبة كمية التحرك ...... الخ و كان له قيمة عددية مقاربه لثابت بلانك فإن عمل هذا النظام يجب ان يوصف في إطار ميكانيكا الكم أما إذا كان للمتغير قيمة عددية كبيره جدا مقارنة بثابت بلانك فقوانين الفيزياء الكلاسيكة تكون صالحه لدرجة كافيه للتطبيق . مثال للتوضيح ... لنفترض متذبذا توافقيا صغيرا لكنه عياني ,,,, و لتكن كتلته 1 gm و سرعته العظمى 1 cm / sec و سعته العظمى x = 1 cm لذا سوف تكون كمية تحركه العظمى p = 1 gm cm sec^-1 و الكمية xp = 1 erg sec هي متغير الفعل للمتذبذب التوافقي نلاحظ من انه مقارنة بثابت بلانك h = 6.626 * 10^-27 erg sec ان القيمة كبيره جدا و لذلك لا يمكننا تطبيق النظريات الكمية ... و يمكن معالجتها كلاسيكيا .. فكلما كان متغير الفعل قريبا من ثابت لانك كلما امكننا تطبيق النظريات الكمية ... و للحديث بقيه في مواضيع أخرى متنوعة المرجع : مقرر بيركلي في الفيزياء(الفيزياء الكمية)
فتمدد الكون و تقلصه لا ينفي السكون الأنتروبي http://www.astro.ucla.edu/~wright/cosmology_faq.html The final entropy of the Universe as it approaches the Big Crunch singularity would be larger than the initial entropy of the Universe because of the heat added by nuclear fusion in stars, so a recollapse does not involve a decrease in entropy the oscillating universe could not be reconciled with the second law of thermodynamics : entropy would build up from oscillation to oscillation and cause heat death أي أن في كل دورة من التقلص و التمدد المفترضة تزداد فيه الأنتروبية و لن تعود النتروبية إلى مستوها السابق عند التقلص المفترض السكون و الحركة أمر نسبي حسب المراقب و الجملة المقارنة و السكون الأنتروبي مصطلح علمي و في السكون الأنتروبي تنعدم الأفعال التلقائية ولا تنعدم الحركة ففي تجربة مزج غازين وبعد تمام الإمتزاج لا تتوقف حركة الغازين وإنما تصبح نسبتهما في كلا الوعائين واحدة وكذلك عند انتقال الحرارة من الجسم الساخن إلى الجسم البارد فتستمر بإنتقال حتى تتساوى درجة حرارة الجسمين وعندها يتوقف انتقال الحرارة ولكن لاتتوقف حركة الجسمين فالذرات و الجزيئات و الإلكترونات في حركة مستمرة قبل التوازن و بعده
نظرية الكم كما ذكرت سابقا لم تستطيع خرق مبدأ حفظ الطاقة و المادة و لكن عمليات التحول من مادة إلى طاقة و بالعكس فهذا ممكن و هذا ما ذكرته في المقال و جود كون آخر أو عدة أكوان أولا لا دليل عليه ثانيا لا يغير من الأمر شيء فيمكن إعتبار كل هذه الأكوان في جملة واحدة و بالتالي تكون مغلقة لأن الماديين لا يعترفون بأي شي خارج حدود المادة و هذا يعطينا نفس النتيجة جملة مغلقة و إزدياد في الأنتروبية و سكون مطلق لكل الأكوان المفترضة و بالتلي سكون أنتروبي للكون الذي نعيس فيه السكون الأنتروبي حتمية لا بد منها بعد فترة من ظهور المادة أيا كان شكلها
ولكن أناقش نهاية الكون بإفتراض أن المادة أزلية وبالنقاش تبين أنه لا يمكن للمادة أن تكون أزلية نهاية المادة بالسكون الأنتروبي غير صحيحة لانها لو كانت صحيحة لوصلت المادة منذ زمن بعيد إلى السكون الأنتروبي فهذا دليل واضح على أن المادة ليست أزلية المجموعة كبيرة من الاراء العلمية في علم الكون والفيزياء الكونية والتي تتحدث عن احتمالات مختلفة ومتباينة حول مصير الكون هي تدعم رأيي و تدعم مقالي وهي تنفي السكون الأنتروبي للكون و بالتالي الكون كله و المادة كله مخلوقة وليست أزلية
و أهلا بك صديقا عزيزا بالمناسبة قمت بمناقشة هذا الموضوع "هل لهذا الكون من إله" في منتدى ملحد و كذلك قمت بمناقشة موضوع انخفاض درجة حرارة الكون إذا كنت مهتم بالأمر أو أي أحد مهتم بالأمر فيمكنني تلخيص ما دار من نقاش و وضعه في المنتدى |
«
الموضوع السابق
|
الموضوع التالي
»
| الذين يشاهدون محتوى الموضوع الآن : 1 ( الأعضاء 0 والزوار 1) | |
| انواع عرض الموضوع |
 الانتقال إلى العرض العادي الانتقال إلى العرض العادي |
 الانتقال إلى العرض المتطور الانتقال إلى العرض المتطور |
 العرض الشجري العرض الشجري |
|
|
المواضيع والمشاركات المنشورة لا تعبر عن رأي ملتقى الفيزيائيين العرب ولانتحمل أي مسؤولية قانونية حيال ذلك ويتحمل كاتبها مسؤولية النشر"
الساعة الآن 04:39





